Etude pilote de la faisabilité d’un traitement multimodal innovant associant une pleurectomie/décortication étendue, une photothérapie dynamique intrapleurale et une chimiothérapie adjuvante chez des patients porteurs d’un mésothéliome pleural malin
En cours / clôturé : cloturé
Type de recherche (rétro/prospectif) : prospectif
Synopsis :
Le mésothéliome pleural malin (MPM) est une tumeur agressive de mauvais pronostic (survie médiane <12 mois). Assez rare (900 cas/an en France), le MPM a cependant une incidence croissante depuis 50 ans. Une exposition antérieure (souvent professionnelle) à l’amiante est le principal facteur étiologique du MPM, diagnostiqué jusque 40 ans après exposition.
Le MPM présente une forte résistance à la chimiothérapie et peu de patients sont des candidats potentiels à une chirurgie radicale comme la pneumonectomie extra-pleurale (PEP) [Figure 1a] responsable d’une morbi-mortalité importante. De plus, la faisabilité d’un traitement multimodal incluant la PEP a été remise en cause par le récent essai clinique « MARS » (Treasure, Lancet Oncol 2011). La PEP est donc progressivement délaissée au profit de la pleurectomie/décortication étendue (« extended P/D ») [Figure 1b], une chirurgie d’exérèse tumorale maximale macroscopique (“debulking” surgery) du MPM, de morbi-mortalité moindre (Rice D, JTO 2011). La P/D même étendue (eP/D) n’est pas un traitement curatif sauf à un stade très précoce et rare du cancer. C’est pourquoi il a été suggéré que la P/D pourrait être intéressante si elle était combinée avec un traitement intra-opératoire et une chimiothérapie (±radiothérapie) adjuvante(s), à évaluer pour les patients candidats à une telle approche multimodale dans un essai clinique prospectif dans des centres spécialisés du MPM.
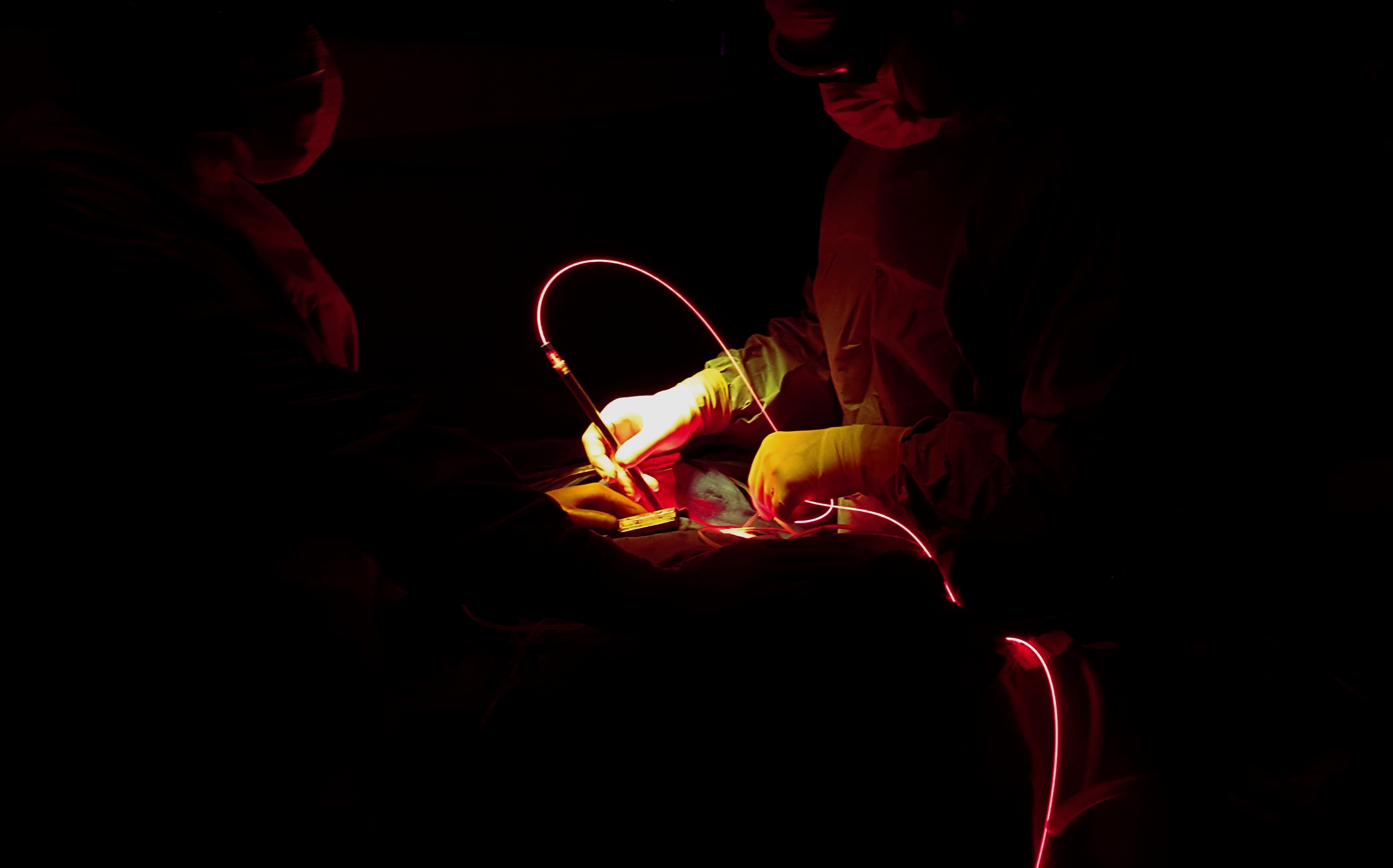
La thérapie photodynamique, ou PDT, est un traitement basé sur le rationnel que les cellules tumorales, si elles sont traitées de manière préliminaire par certaines drogues photosensibilisantes, mourront quand elles seront exposées à la lumière à une fréquence particulière. L’agent photosensibilisant (dérivé de l’hématoporphyrine, Photofrin®), injecté dans la circulation sanguine 24 heures avant la chirurgie du MPM, est absorbé par toutes les cellules mais persiste plus longtemps dans les cellules tumorales que dans les cellules normales. Pendant l’intervention, le chirurgien illumine avec la source lumineuse laser directement la cavité pleurale [Figure 2] produisant une bande étroite de fréquences lumineuses spécifiquement absorbées par la drogue photosensibilisante. Quand les cellules tumorales absorbent la lumière, cette drogue produit des radicaux libres de l’oxygène tuant les cellules tumorales environnantes et l’angiogénèse tumorale sur une épaisseur maximale de tissu de quelques millimètres. De manière intéressante, la PDT pourrait aussi stimuler la réponse immune anti-tumorale via la libération d’antigènes tumoraux induite.
Ainsi, la PDT intrapleurale a été testée dans des essais cliniques de phase I et II pour les patients porteurs d’un MPM en combinaison avec la PEP ou la P/D, et une chimiothérapie. Les données préliminaires anciennes (1991-2004) déjà avec le Photofrin® ou le Foscan® ont été plutôt décevantes, sans gain de survie, mais associées alors à des types de chirurgie hétérogènes pour le mésothéliome. Une étude américaine récente par Friedberg et al. a trouvé des résultats très prometteurs de survie dans le MPM par la combinaison d’une P/D « radicale » (équivalent d’une P/D étendue), mais pas de la PEP, d’une PDT intra-opératoire et d’une chimiothérapie (cisplatine + pémétrexed), avec une survie sans progression (SSP) médiane de 2,1 ans. Cette augmentation spectaculaire a depuis été confirmée sur une série plus large de patients (n=38) opérés d’un MPM par eP/D et PDT puis chimiothérapie avec une survie globale (SG) médiane de 31,7 mois (Friedberg et al, Ann Thorac Surg 2012), à comparer dans la littérature aux meilleures SG obtenues par traitement multimodal sans PDT (environ 18 mois) ou par chimiothérapie seule (12 mois). L’effet indésirable principal de la PDT est la photosensibilisation, potentiellement jusque 6 semaines après traitement.
C’est pourquoi ce projet étudiera en France l’intérêt d’un tel traitement multimodal en collaboration avec l’équipe du Pr J. Friedberg, Philadelphie (USA). La première étape proposée est la mise en place de ce protocole thérapeutique multimodal américain innovant, incluant une eP/D, la PDT intrapleurale, la radiothérapie prophylactique des orifices de drains et chirurgicaux et une chimiothérapie par 6 cycles maximum de platine et pémétrexed, par un essai clinique de phase II de faisabilité, monocentrique au CHRU de Lille (n= 6 patients). Cet essai est financé par le Conseil régional Nord-Pas de Calais et les dons des patients.
Le critère principal sera la faisabilité évaluée par la proportion de patients ayant pu faire l’objet du traitement multimodal complet, incluant la PDT intrapleurale, dans les délais impartis et sans toxicités inacceptables et inattendues (objectif attendu : 66% minimum soit 4 patients /6). Les critères secondaires de jugement sont le taux de contrôle de la maladie (DCR) à 1 an post-opératoire, la survie sans progression (SSP) et la qualité de vie des patients (questionnaire EORTC LC30), associés à des études ancillaires sur le monitorage de l’illumination de la cavité pleurale lors de la PDT et sur l’évaluation de la réponse au traitement par des biomarqueurs tumoraux sanguins et la tomographie par émission de positons couplée au scanner (TEP-TDM).
Nous visons ainsi à améliorer le traitement et le pronostic, sombre à ce jour, des patients par le développement d’une telle stratégie thérapeutique innovante pour le MPM.
En perspective, avec le Pr Serge Mordon de l’unité INSERM U703 (Eurasanté de Lille), nous cherchons de nouvelles solutions techniques pour améliorer l’illumination de la cavité pleurale (« tissu pleural » lumineux, modélisation 3D préalable de la cavité pleurale du patient) et l’efficacité de la PDT contre le MPM. Sous réserve de résultats positifs de cette essai de faisabilité, il est prévu une évaluation de l’apport de la PDT intrapleurale dans la prise en charge multimodale du MPM par un essai clinique de phase II multicentrique (5 centres experts français coordonnés par le CHRU de Lille), randomisé : eP/D étendue et chimiothérapie, avec ou sans PDT intrapleurale (n= 45 patients par bras). Cet essai est financé dans le cadre du PHRC National Cancer 2013 (coordonnateur : Pr A. Scherpereel).
Principal·e investigateur·rice : Pr. Arnaud SCHERPEREEL
Scientifique coordinateur·rice : Pr. Serge MORDON
Sponsor de l’étude : CHU de Lille
Objectif principal : Evaluer la faisabilité de la réalisation du traitement multimodal innovant complet incluant la PDT intrapleurale, dans les délais impartis et sans toxicités inacceptables et inattendues.
Objectifs secondaires :
Evaluation du taux de contrôle de la maladie (répondeurs ou stables) à 12 mois post-opératoires
- Evaluation de la survie sans progression
- Evaluation de la qualité de vie
- Evaluation de la réponse au traitement (biologie et imagerie)
Critère d’évaluation primaire :
Proportion de patients recevant le traitement multimodal complet, incluant la PDT intrapleurale (objectif attendu : 66% minimum soit 4 / 6 patients), selon les critères suivants :
- Réalisation du traitement multimodal complet: injection 24h ou 48h pré-opératoire du photosensibilisant (Photofrin), chirurgie d’exérèse de type eP/D, PDT intrapleurale, radiothérapie prophylactique (21 Gy) des orifices de drains et cicatrices chirurgicales, chimiothérapie adjuvante par 4 à 6 cycles de platine et pémétrexed.
- Réalisation de ce protocole thérapeutique complet dans les délais impartis: au maximum dans les 9 mois après la chirurgie par eP/D (+PDT intrapleurale) : radiothérapie prophylactique dans les 2 mois post-opératoires et chimiothérapie adjuvante (cycles de 21 jours minimum (maximum tous les 5 semaines) x 4 à 6 cycles) à débuter dans les 3 mois post-opératoires.
- Evaluation du profil de tolérance : toxicités inacceptables et inattendues (grade ≥ 3) selon les critères de toxicité du National Cancer Institute (NCI) (revues par un Comité de Surveillance Indépendant).
Critères d’évaluation secondaires :
- Nombre de patients (répondeurs ou stables selon les critères RECIST modifiés) à 12 mois post-opératoires
- Survie sans progression (SSP) déterminée à partir de la date d'inclusion jusqu’à la date de rechute
- Qualité de vie évaluée par un questionnaire spécifique du MPM (EORTC LCSS-30) en pré et post-thérapeutique
- Réponse au traitement par des biomarqueurs tumoraux sanguins et la tomographie par émission de positons couplée au scanner (TEP-TDM)
Recrutement estimé : 6 patients
Identifiant clinicaltrials.gov : NCT02662504
Contact et localisation :
Pr. Arnaud SCHERPEREEL
Pneumologie et Oncologie Thoracique, Hôpital Calmette, CHRU de Lille
Tel : 03 20 44 49 98